有些癌症细胞尽管最初能被药物所抑制,但随着对药物产生抗性而再次生长。另一些癌症细胞则扩增极快,乃至药物的抑制作用无法表现出来。上周发表的两篇科学论文通过针对癌症的生存和扩增机制,为治疗难治性肿瘤提供了潜在的新方法。
第一篇由辛辛那提大学俄亥俄分校的研究人员发表在《Cell Reports》上的文章,研究了细胞的“自噬”机理。自噬作用类似细胞的回收循环利用机制,废物被运送到溶酶体进行消化降解,借此产生新能源。当营养和能量不足时,细胞就会启动自噬作用,该作用可以被mTOR(哺乳动物雷帕霉素靶标)和AMPK(AMP激活的蛋白质激酶)调节。

糖酵解(glycolysis)和氧化磷酸化(OXPHOS)的缺陷,对自噬有着相反的作用(图片来源:参考资料[1])
研究发现细胞代谢中,糖酵解和氧化磷酸化的缺陷,对自噬有着相反作用。当代谢倾向于氧化磷酸化途径时,线粒体代谢增强,引发自噬增强。这与mTOR抑制剂作为一种抗癌药物,能增强线粒体代谢,引发癌细胞自噬的功能相符。线粒体复合体I是自噬启动及幅度和持续时间的重要影响因子。线粒体复合体I缺陷可以抑制mTOR抑制剂引发的自噬。两种可以抑制线粒体复合体I的糖尿病药物——苯乙双胍(phenoformin)和二甲双胍(metformin),也有类似的抑制作用。
辛辛那提大学俄亥俄分校血液病和肿瘤学副教授Carol Mercer博士表示:“我们的数据证明了代谢通路在自噬调节中的重要性,增加了我们对重要的癌症临床药物的理解,并提出了增加或抑制自噬的新策略。”
在另一篇发表在《Nature Communications》的科学论文中,多伦多大学的研究人员则专注于研究名为NUAK2(又名SNARK,蔗糖非发酵类激酶)的一种AMPK激酶,在癌症细胞增殖中的作用。

作者发现在部分人类膀胱癌患者中NUAK2水平升高,并与YAP/TAZ基因特征具有强相关性。研究进一步确认促进细胞非正常生长的致癌蛋白——转录因子YAP和TAZ,可以激活NUAK2蛋白的表达。YAP/TAZ是调节细胞和组织正常生长的重要河马信号通路(Hippo pathway)的一部分。河马信号通路因为可以控制器官大小,失控时能导致器官增殖到像“河马”一样异常巨大而被命名。在多数实体瘤中,由于未知机理导致河马信号通路失活,转录因子YAP/TAZ则因此大量激活。YAP/TAZ在癌症中非常活跃,它可以进入细胞核结合DNA,激活促进细胞增殖的多个基因。
出人意料的是,NUAK2不仅是YAP/TAZ下游被激活基因中的一种,它还同时可以帮助更多的YAP/TAZ进入细胞核以结合DNA,从而促进细胞的异常生长。文章阐明NUAK2直接抑制LATS对YAP/TAZ的磷酸化,而YAP/TAZ的磷酸化帮助它们定位于细胞质,同时YAP/TAZ和AP-1导致的NUAK2激活是增强YAP/TAZ信号的必须环节。
进一步试验表明,沉默NUAK2基因或药物抑制NUAK2蛋白,可以阻止YAP/TAZ进入细胞核,从而打断癌细胞不断增殖的恶性循环。通过这些手段,研究人员可以在细胞培养实验中抑制癌细胞生长,并在小鼠模型中缩小乳腺癌肿瘤。
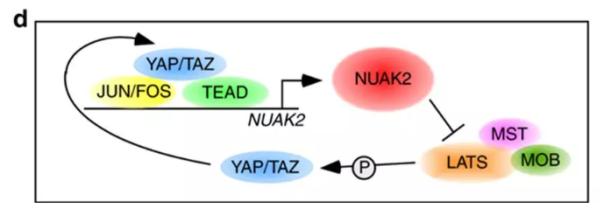
YAP/TAZ的NUAK2正向前馈控制回路(图片来源:参考资料[2])
尽管研究人员此前发现河马途径在许多癌症类型中失活,但一直没有找到靶向该途径的药物。此篇关于NUAK2的报道改变了这一点。这些发现确定了河马信号通路中的一种正向前馈控制回路,也确立了NUAK2在加强YAP/TAZ致癌作用中的关键角色。研究结果表明,NUAK2是一个介入河马信号通路的潜在靶点,为癌症治疗带来了新的机会。
多伦多大学教授Liliana Attisano博士在一份声明中表示:“在对膀胱癌的研究中,我们发现其中一部分患者的肿瘤中,特别是后期肿瘤中,NUAK2蛋白水平高。”研究人员认为,可以通过检测患者的肿瘤是否具有高水平的NUAK2,确立潜在目标患者群。
该团队正在努力将他们开发的NUAK2蛋白抑制剂转化为适于在动物中使用的药物,准备进行进一步试验验证这一靶点。
参考资料:
[1]. Mercer, et al., (2018). Mitochondrial Complex I Activity Is Required for Maximal Autophagy. Cell Report. https://doi.org/10.1016/j.celrep.2018.07.101
[2]. Attisano, et al., (2018). A feed forward loop enforces YAP/TAZ signaling during tumorigenesis. Nature Communications. https://doi.org/10.1038/s41467-018-05939-2
[3]. Thwarting cancer by targeting cell survival and growth. Retrieved August 31, 2018, from https://www.fiercebiotech.com/research/thwarting-cancer-by-targeting-cell-survival-and-growth
[4]. New way to break cancer's vicious cycle. Retrieved August 31, 2018, from https://www.sciencedaily.com/releases/2018/08/180829081336.htm
