近年来,嵌合抗原受体(CAR)T细胞疗法已经发生了革命性的发展。CAR是合成的T细胞受体,其将肿瘤特异性结合结构域融合至T细胞活化信号以赋予其肿瘤特异性细胞毒性。可以收集患者来源的T细胞并离体转导以表达CAR,然后返回患者以介导肿瘤根除。
经过数十年的临床前开发,靶向CD19的CAR-T细胞实现了出色的临床反应,CD19是一种B细胞抗原,具有大多数B细胞恶性肿瘤的保守表达。CD19 CAR-T细胞的成功也大大推动了这类疗法的商业推出。

CAR-T细胞治疗的进展(图片来源:Science Translational Medicine)
从CAR-T细胞疗法的发展时间轴来看,早期CAR-T细胞临床试验的成功推动了该领域从小型早期试验到FDA批准商业化细胞产品的快速发展。持续的进展将需要解决生物学挑战,包括限制CAR T细胞在非B细胞恶性肿瘤中的功效的障碍,以及解决目前限制这些疗法对患者的可及性的制造挑战。
1.挖掘CAR-T细胞的潜能
早期试验的成功促使FDA在2017年批准了tisagenlecleucel(Kymriah),一种CD19特异性4-1BB-ζCAR构建体,用于治疗儿童和年轻人的复发或难治性CD19+ B细胞急性淋巴细胞白血病(ALL),一项2期多机构试验结果显示,输注后3个月内缓解率为81%。
此后不久,FDA批准了axicabtagene ciloleucel(Yescarta),一种CD19特异性CD28-ζCAR构建体,用于难治性大B细胞淋巴瘤成人患者,2期实验显示54%的患者表现出完全反应(CR)。
近日,2019年的第一届欧洲CAR-T大会上,宾大Carl June团队公布CD19特异性CAR-T疗法CTL119联合Ibrutinib(依鲁替尼)治疗复发/难治性慢性淋巴细胞白血病(CLL)的最新结果,13/19名患者在第12个月达到MRD阴性(治疗后血液或骨髓中残留的CLL细胞比例<1/10000个白血细胞)。鉴于相关临床试验的疗效和安全性数据,CLL有望成为CAR-T疗法的新适应症。
另一个具有极大潜力的适应症是多发性骨髓瘤(MM),目前针对该适应症的BCMA靶向CAR-T研发正热火朝天。国内方面,南京传奇、恒润达生和科济生物均已获批临床。
2.CAR-T细胞扩增和持久性
剖析持久临床反应的驱动因素仍然是一个挑战。关于CAR-T细胞扩增、持久性和临床反应之间的关系研究已有不同的报道。
CLL的经验表明体内扩增与CAR-T细胞持久性和临床反应相关,大B细胞淋巴瘤的研究也表明扩增与临床反应相关。儿童ALL中tisagenlecleucel的2期研究未发现应答者和无应答者之间CAR-T细胞扩增的差异,但持续性确实与持续的临床反应相关。
淋巴细胞清除(清髓)方案对输注后允许稳态CAR-T细胞扩增是至关重要的。
对接受基于环磷酰胺的淋巴细胞清除的非霍奇金淋巴瘤患者的CAR-T细胞扩增和临床结果的比较显示,加入氟达拉滨后存活率更高(8%的临床反应与50%的临床反应相比)。尽管在CAR-T细胞转化的早期阶段,机构间预处理方案变化很大,但基于环磷酰胺和氟达拉滨的方案是目前淋巴细胞清除的标准。
CAR设计和内在特性也会影响CAR-T细胞的扩增和持久性。
包含CD3-ζ信号结构域和共刺激结构域(通常为CD28或4-1BB)的第二代CAR仍然是临床使用中最常见的构建体,但显示出不同的动力学。
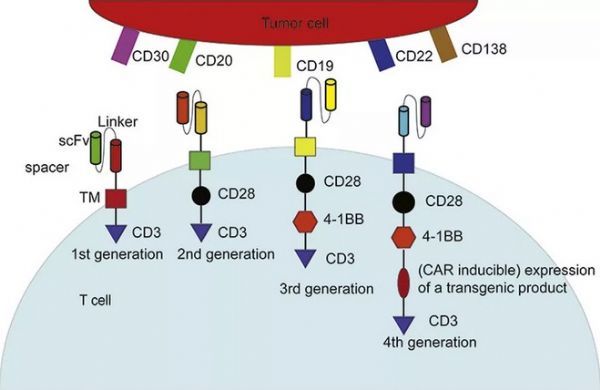
四代CAR-T细胞和肿瘤细胞共同靶标的基本结构示意图。CAR构建体由特异性针对细胞表面抗原的抗体单链片段(scFv, 胞外区段)以及来自天然TCR复合物和共刺激分子(胞内区段)的一个或多个融合信号传导结构域组成。不同的细胞内区段代表各种CAR-T细胞世代。scFv:单链片段。TM:跨膜区。(图片来源:Acta Pharmaceutica Sinica B)
CD28可以实现更快速的CAR-T细胞扩增,并可能更快地消除肿瘤,正如使用临床前模型所证明的那样,滴定以确定CAR-T细胞间的功效差异。
然而,共刺激也会影响CAR-T细胞的持久性和衰竭。慢性CAR信号模型证明,4-1BB共刺激可改善T细胞衰竭,这为为什么携带4-1BB的CAR-T细胞比携带CD28的CAR-T细胞更持久提供了生物学解释。
第三代CAR,包括那些具有两个共刺激结构域的CAR,未显示出超过第二代CAR的临床优势。
关于CAR-T细胞持久性,因疾病类型而影响临床结果。
4-1BB CAR-T细胞持久性与B-ALL的持续临床缓解相关。携带CD28的CAR-T细胞,无法实现长期持续存在,对淋巴瘤有效,但不是ALL。
预期CAR-T细胞的持久性降低可能是有效的,甚至可用于治疗急性髓性白血病(AML)。CAR-T细胞的许多AML靶标已进入临床转化阶段,但在造血干细胞和祖细胞上表达保守,使得针对AML靶标的CAR-T细胞长期持久性可能不是研究者所期望的。
理想的CAR-T细胞特性似乎因疾病而异,因此不太可能出现一种构型成为所有恶性肿瘤的最佳治疗方案。
3.CAR-T疗法毒性
细胞因子释放综合征(CRS)和神经毒性,是CAR-T细胞疗法的主要毒性副作用,其范围从轻微到危及生命,风险与疾病负担相关。
这些毒性的评估和分级在临床试验和各机构之间差异很大,因此难以比较不同产品的安全性,并且难以制定管理这些毒性的最佳策略。此外,这些分级系统可能难以跨中心实施。
累积经验促进了标准化的临床指南,以增强CAR-T细胞的安全性。例如,为了协调CRS和神经毒性的定义和分级系统,该领域的专家于2018年6月20日和21日在美国血液和骨髓移植协会(ASBMT)支持的会议达成共识建议,并提出客观、易于应用的CRS和神经毒性的新定义和分级,并最终更准确地分类这些毒性的严重程度。
目前,CRS治疗使用托珠单抗(Tocilizumab),这是一种针对IL-6受体的人源化单克隆抗体,2017年8月被FDA批准用于CAR-T诱导的严重或危及生命的CRS。在大多数患者中施用托珠单抗后,已证实CRS的快速消退。在临床转化早期,尚不清楚中止CRS是否会同时破坏CAR-T细胞功效,因此这种干预通常会延迟到后期毒性阶段。
研究表明,管理毒性的托珠单抗或类固醇不是影响临床反应率的独立变量,并且这些药物用于治疗CAR-T细胞相关毒性的用途已经放开。
4.CD19抗原丢失是主要的复发驱动因素
众所周知,CD19绝对称得上是CAR-T治疗靶点中的当家花旦,已经在复发难治性B细胞恶性血液疾病获得了极大的成功,并且已经有两款商业化产品也都基于CD19特异性CAR。
CD19是一种特异性表达于B淋巴细胞各个分化阶段的细胞表面抗原,绝大多数B系来源的恶性肿瘤包括B细胞急性淋巴细胞白血病、慢性淋巴细胞白血病和非霍奇金淋巴瘤细胞表达CD19。
但并不是所有患者都能从CD19 CAR-T疗法中获益。尽管ALL患者CAR-T细胞治疗后的初始临床缓解率高达90%,但长期随访的存活率显著降低。在前面提到的2期儿科ALL研究中,尽管输注后3个月的客观缓解率达到81%,但12个月时的无事件生存率降至50%。此外,在该研究中复发的16名可评估患者中,15名患者出现了缺乏CD19的白血病,从而逃过了CD19 CAR-T细胞的识别。
5.除了CD19?
血液系统恶性肿瘤
CD19阴性B细胞白血病复发的现象促使科学家积极寻找其它的B细胞抗原靶点。
2017年底,斯坦福大学医学院Crystal Mackall团队和美国国家癌症研究所(NCI)在权威学术期刊Nature Medicine上报告了CD22 CAR-T治疗复发B-ALL患者的一项1期临床试验结果。该试验中,15名疾病复发或对靶向CD19的CAR-T疗法没有反应的患者接受了靶向CD22的CAR-T治疗,其中有10人曾接受过靶向CD19的治疗但产生抗性。
结果发现,客观缓解率达到73%,中位缓解时间为6个月,其中有3人分别在接受治疗后的第6、9和21个月依旧保持完全缓解。此外,患者对这一疗法的耐受性良好。临床缓解率与CD19-CAR T细胞的比率相当,但也观察到抗原重构和CD22下调。
值得一提的是,我国CAR-T研究领域也有相关进展。针对治疗时由于靶点丢失造成的高复发率问题,周剑锋教授临床团队以及武汉波睿达生物科技有限公司张同存教授技术团队做了大量的研究工作。该团队在2016年初设计、注册并启动了CD19/CD22 CAR-T序贯回输的临床研究。
2017年12月,第59届美国血液学年会(ASH)年会上,周剑锋教授展示了全球首个采用两种CAR-T细胞序贯回输进行难治复发B细胞血液肿瘤治疗的临床研究。针对B-ALL,完全缓解率(CR)达90%以上,部分缓解(PR)约7%。
目前,CD19/CD22或CD19/CD20双靶点CAR-T也已显示出前景,并且正在进行用于规避抗原下调的双特异性靶向的试验。例如,河北森朗生物正在进行CD19/CD22双靶点CAR-T研究。
针对其它B细胞恶性肿瘤的替代抗原还包括以下,仍处于早期临床阶段。例如,难治性霍奇金淋巴瘤:CD30;AML:CD33、CD123和FLT3;多发性骨髓瘤:BCMA。
实体瘤
将CAR-T细胞应用延伸至实体瘤是近年的一大主题,然而,尚未实现与用于血液癌症的CD19 CAR-T细胞疗法相当的效果。还面临着多个必须解决的挑战:
在实体瘤中CAR-T细胞治疗的众多挑战中,一个主要障碍是缺乏真正的肿瘤特异性靶抗原,这迫使细胞免疫学家靶向在肿瘤上过表达的肿瘤相关抗原(tumor-associated antigens, TAAs),但由于TAA也在正常组织和器官表达,具有安全风险。
此外,实体瘤的肿瘤微环境(tumor microenvironment, TME)特别是免疫抑制剂,阻止有效的抗肿瘤免疫应答。免疫抑制性TME含有多种成分,包括物理屏障,如致密的细胞外基质;功能失调的上皮细胞;代谢检查点,如缺氧;免疫屏障,如免疫抑制细胞因子/分子和免疫抑制性免疫细胞。
下一代CAR设计和瘤内注射治疗实体瘤可提高CAR-T细胞功效。
2016年12月29日,一项发表在临床领域顶级期刊NEJM上的研究表明:颅内递送的IL-13Rα2特异性CAR-T细胞在胶质母细胞瘤患者中实现了7.5个月的消退。而这是CAR-T疗法首次在实体瘤治疗中获得的重大突破。
这一经验强调了对实体瘤中替代剂量和给药策略的可能需求,并激发了CAR-T细胞治疗实体瘤的希望。
越来越多的针对实体瘤抗原的CAR-T临床试验相继开展,以下是一些相关靶点:例如,通过靶向间皮素(meso)治疗胰腺癌,通过靶向成纤维细胞活化蛋白(FAP)治疗恶性胸膜间皮瘤,通过靶向神经节苷脂GD2治疗神经母细胞瘤,通过靶向癌胚抗原(CEA)治疗结直肠腺癌,通过靶向表皮生长因子受体(EGFR)治疗非小细胞肺癌,通过靶向δ样蛋白3(DLL3)治疗小细胞肺癌,通过靶向整合素相关蛋白(CD47)治疗卵巢癌和结肠直肠癌等。
而在近日,科济生物获得了国内实体瘤CAR-T的第一张临床批件:GPC3靶向的CAR-T细胞用于治疗GPC3阳性实体肿瘤。
6.设计下一代CAR-T细胞产品
CAR的基本结构是模块化的,用于识别抗原的单链可变区(Single-chainvariable fragment, scFv)、铰链、跨膜区域、共刺激域和一个T细胞激活域。
目前,科学家还在进行进一步的工程策略,以允许CAR-T细胞介导的细胞因子递送、检查点阻断部分的分泌、T细胞衰竭的调节和可调节的“安全开关”。
例如,2018年8月13日发表在Nature Biotechnology上的一项研究,MSKCC(纪念斯隆凯特琳癌症中心)联合优瑞科公司制作了“装甲CAR”,新设计的CAR-T细胞分泌一种迷你版本的检查点阻断抗体;Bellicum公司拥有自主研发的GoCAR-T技术,使CAR包含两个共刺激信号结构域活化开关。
此外,利用精确的基因编辑技术开发现成(同种异体)的CAR-T细胞产品,包括CRISPR介导的供体CAR-T细胞上的内源性T细胞受体的消除,以预防移植物抗宿主病,并生成不易被宿主异体免疫反应排斥的CAR - T细胞。
在国内,邦耀生物、北恒生物、克睿基因等在积极布局通用型CAR-T。
迄今为止,大多数临床研究使用CAR-T细胞产品中混合的T细胞群,其在患者个体之间差异很大。目前正在研究可变T细胞亚群组成的结果,以确定是否可以鉴定定义的和有效的子集。
7.正在面临的挑战
尽管与CAR-T细胞疗法优化相关的科学挑战是多方面的,但让这些治疗变得更便宜、更容易获得的需求也同样迫切。
该领域最初起源于各个学术研究中心,现已发展成为商业分销的集中模式。这些产品的价格很高,axicabtagene ciloleucel的价格为37.3美元,tisagenlecleucel为47.5美元。尽管ALL中的CAR-T疗法有时可以替代干细胞移植,但通常被用作移植的桥梁,从而导致两种疗法的成本。
预计制造过程的改进和商品成本的降低,最终可能促使价格降低和支持可扩展性。目前,处于早期临床试验阶段的现成CAR-T细胞是解决个体化CAR-T细胞产品的制造复杂性和高成本的替代策略。
CAR-T细胞疗法在十年内从学术中心的研究迅速转化为全球商业化生产,这是一个了不起的成功故事。
未来的科学和临床进展将扩大这些疗法对更多患者的影响。释放这种强效治疗的全部潜力将取决于提高我们对血液癌症和实体肿瘤中原发性和继发性耐药基础的理解,开发利用CAR工程改进的下一代产品,以及克服与成本和可扩展性相关的主要障碍。
参考出处:
DOI: 10.1126/scitranslmed.aaw2127
https://www.researchgate.net/figure/llustration-of-basic-structure-of-4-generations-of-chimeric-antigen-receptor-T-cells_fig1_324255061
https://www.sciencedirect.com/science/article/pii/S1083879118316914
原标题:CAR-T细胞治疗从学术走向商业化创造了医药史上的奇迹,未来的挑战与希望并存
