突破性疗法(Breakthrough Therapies,BT)是美国FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病并且有初步临床证据表明与现有治疗药物相比能够实质性改善病情的新药。获得突破性药物资格(BTD)的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内获批上市,为患者提供新的治疗选择。
BTD也是继快速通道(fast track,FT)、优先审评(priority review,PR)、加速批准(accelerated approval,AA)之后的第4个特别审批通道,能够加快新药的审查和批准。自2012年实施以来,已有相当多数量的抗癌药被授予BTD并获批上市,造福各类癌症患者。
然而,近日发表于美国《临床肿瘤学》(J Clin Oncol)杂志上的一项研究显示,与非突破性药物相比,突破性药物在安全性、新颖性或有效性方面并没有表现“突破性”的改善。
在这项研究中,哈佛大学医学院副教授Aaron S. Kesselheim博士和他的同事根据FDA的Drugs@FDA数据库分析了2012年1月至2017年12月期间批准的所有抗癌新药,提取了实验性新药申请(IND,标志着启动人体临床研究)和首次获FDA批准的日期、适应症、药物作用机制、癌症类型、一线或多线治疗(初治或经治)、癌症阶段(是否晚期/转移性)、孤儿药资格、加速项目(PR,AA,FT,BTD)等相关数据,同时也提取了用于支持FDA批准的关键临床研究中包括总生存期(OS)、无进展生存期(PFS)、缓解率(RR)、安全性及其他终点在内的关键数据。
结果显示:从BTD项目实施以来到2017年,有接近一半的抗癌药物被授予突破性药物资格。具体而言,从2012-2017年期间,FDA共批准了58种抗癌新药,其中55种(95%)至少通过一种项目被加速:25种(43%)获得BTD,26种获得AA,28种获得FT,46种获得PR。此外,42种药物(72%)被授予孤儿药资格,大多数药物是靶向实体瘤(37种药物,64%)以及适应于既往已治疗或难治性疾病(36种药物,62%)。22种药物(38%)具有新的作用机制。若将BTD实施前2年(2012和2013)获批的药物排除在外,则有23种(59%)获得突破性药物资格。

(1)首次批准时间
从IND批准之日算起,BTD药物和非BTD药物首次获得FDA批准的中位时间分别为5.2年和7.1年,数据具有显著性差异(相差1.9年[27%],p=0.01)。此外,与非BTD药物相比,BTD药物更可能使用AA(68% vs 27%,p=0.003),但在使用任何其他加速通道上并不具有显著的可能性。

与获得BTD但未获得AA的药物相比,同时获得BTD和AA的药物的中位审批时间也显著较短(4.8年 vs 8.3年,p=0.009)。在对所有加速通道、孤儿药资格、药物、疾病、肿瘤特征等协变量进行调整后的多元Cox回归分析中,BTD和AA之间的交互作用是批准时间的唯一显著预测因子(HR=3.0,95%CI:1.4-6.4,p=0.005,见图1)。
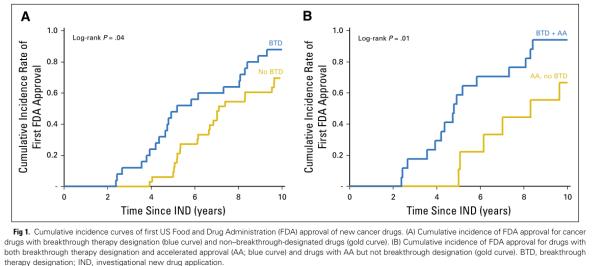
(2)机制新颖性、RR、OS
在58种抗癌药中,8种(14%)主要基于OS和PFS数据批准,19种(33%)主要基于PFS数据批准,2种(3%)基于OS和PFS数据批准,1种(2%)基于无侵入性生存数据批,28种(48%)基于RR数据批准。在25种突破性资格药物中,16种(64%)基于RR数据批准,8种(32%)基于PFS数据批准,1种(4%)基于OS数据批准(见表3)。此外,BTD资格药物(4% vs 27%)和AA资格药物(0% vs 31%)显著更少地基于OS作为主要或共同主要终点获批,而不是PR资格(17% vs 17%)或FT资格(25% vs 10%)。
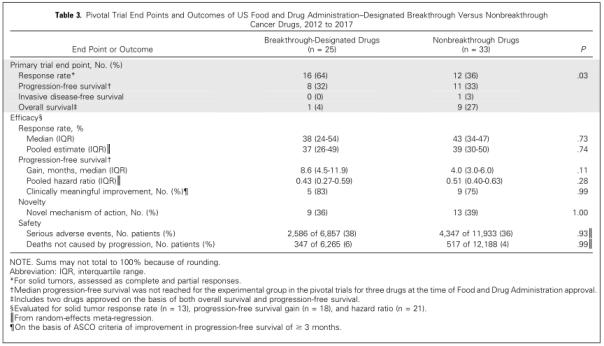
PFS方面,BTD药物在中位PFS获益方面略高但不具有统计学差异(8.6个月 vs 4.0个月,p=0.11),此外,在PFS危险比(0.43 vs 0.51,p=0.28)、实体瘤中位RR方面(38% vs 43%,p=0.73)也无统计学差异。meta回归分析在横跨所有药物中没有发现BTD资格与PFS危险比(0.43 [95%CI:0.27-0.59] vs 0.51 [95%CI:0.40-0.63],p=0.28)或RR(37% [95%CI:26%-49%] vs 39% [95%CI:30%-50%],p=0.74)之间的关联性。
6种BTD药物中有5种、12种非BTD药物中有9种达到了具有临床意义改善的基准(≥3个月)。BTD药物在创新作用机制方面与非BTD药物不具有优越性(36% vs. 39%,p=1.00)。在敏感性分析中,排除2012-2013年的药物后获得了相似的结果。
(3)安全性
在该项研究队列的中有抗癌药的关键性临床研究中,严重不良事件在BTD药物治疗的患者中的发生率为38%(n=2586/6857)、非BTD药物治疗的患者中为36%(n=4347/11933)(随机性效应meta回归中亚组间异质性检验p=0.93)。死亡比例方面,BTD药物和非BTD药物之间无显著性差异(6% vs 4%,随机性效应meta回归的p=0.99)。
根据上述分析结果,研究人员得出结论:与非BTD资格药物相比,BTD资格药物在监管审批方面从IND到获得批准的时间更短,但没有证据表明BTD资格药物能够带来改善的安全性或机制新颖性,在疗效方面也不具有显著优势。
在与该项研究相关的编辑评论中,美国弗莱德哈钦森癌症研究中心肿瘤学家Nicole M. Kuderer写道,FDA的目标应该是同时保护患者不受不良事件的影响,并允许患者及时获得潜在挽救生命的药物。尽管在没有重大安全问题的情况下对有前途的药物缩短审批时间是很合理的,但仍需要合理的药物审批以避免未来药物审批方面的定量配给。针对重大疾病设定临床意义的基准,将帮助FDA聚焦于批准最有效的药物。与此同时,对新监管模式的影响进行严谨认真的持续评估也是至关重要的。同样地,监管机构、临床医生和患者需要系统地参与进来并提出解决方案,来更好地平衡对有前途新药的获取以及更好地保护患者免受伤害。(新浪医药编译/newborn)
文章参考来源:
1、FDA breakthrough therapy designation not associated with improved safety, efficacy
2、Efficacy, Safety, and Regulatory Approval of Food and Drug Administration-Designated Breakthrough and Nonbreakthrough Cancer Medicines.
