近日,阿斯利康与第一三共宣布针对抗体偶联药物trastuzumab deruxtecan(DS-8201)签订全球开发和商业化合作协议,双方共同负责DS-8201在全球(日本除外)的开发和商业化,第一三共保留在日本的市场专有权并全权负责生产和供应。为此,阿斯利康向第一三共支付13.5亿美元首付款,以及后续的研发注册和商业里程金,交易金额总计69亿美元。
在全球制药行业,大小公司之间的交易历来十分频繁,且不说那些实力雄厚自带光环的跨国制药巨头,就连背靠资本扶持的初创生物医药公司也能在交易市场掀起收购的狂风巨浪。近年来,阿斯利康在产品和公司收购方面倒是一直十分审慎,此次与第一三共达成的这笔总额69亿美元的合作也是阿斯利康为数不多的大手笔收购,着实引人关注。
那么不禁要问:阿斯利康此次为何愿意不惜重金收购DS-8201这项资产?
阿斯利康的雄心
肿瘤是全球药品市场规模最大的一个疾病领域,据医药魔方统计,2018年全球TOP10药品销售收入合计880亿美元,其中肿瘤药独占6席,销售收入更是占据半壁江山,达到443.5亿美元。近些年免疫疗法的火热也让肿瘤成为吸引制药行业关注和资源投入最多的领域。
阿斯利康是较早涉足肿瘤领域的巨头之一,在肺癌、乳腺癌、卵巢癌、前列腺癌治疗领域颇有建树,1977年推出了其第一个抗肿瘤药物Nolvadex(他莫昔芬),这也是历史上第一个靶向雌激素受体的乳腺癌内分泌治疗药物。此后阿斯利康相继上市了3款乳腺癌内分泌治疗药物,分别是1987年的诺雷得(戈舍瑞林,一种合成的促性激素释放激素的类似物),1995年的瑞宁得(阿那曲唑,一种高选择性非甾体类芳香化酶抑制剂)和2002年的芙仕得(氟维司群,一种雌激素受体下调剂),覆盖了从早期到晚期、绝经前到绝经后的激素受体阳性乳腺癌患者。凭借Nolvadex和上述“三得”产品,为65%-70%的乳腺癌患者提供了从A到Z(A:瑞宁得、F:芙仕得、N:他莫昔芬,Z:诺雷得)的全程管理,成就了阿斯利康在乳腺癌内分泌治疗领域当之无愧的领导者地位,也使其在肿瘤药市场确立了极强的存在感。
阿斯利康当前的肿瘤业务重心聚焦在肺癌、乳腺癌、卵巢癌和前列腺癌4大领域,未来还将拓展血液肿瘤、消化道肿瘤等,而分析其产品线可以发现,阿斯利康已经围绕肿瘤基因驱动和耐药性、DNA损伤应答、肿瘤免疫治疗以及抗体偶联药物布局建立了4大机制的研发管线。先对这4个方向做一介绍,或许大家就能明白阿斯利康收购DS-8201的要义所在。
肿瘤基因驱动和耐药性
人们对癌症治疗的理解有三个里程碑式的突破,其中之一就包括发现肿瘤的发生进展、治疗耐药与驱动基因有关。比如,通过靶向药物有效抑制肿瘤驱动基因就可以抑制并延缓肿瘤进展并改善生存期,但是很多肿瘤最终都会对当前治疗药物产生耐药。因此,阿斯利康致力于研究肿瘤基因突变和耐药机制,为病患带来更多有意义的临床改善。
EGFR基因突变在非小细胞肺癌患者中比较常见,阿斯利康则是研发EGFR-TKI药物的开路先锋,第一代EGFR抑制剂易瑞沙(吉非替尼)开启晚期非小细胞肺癌精准诊疗时代。接受吉非替尼治疗的患者平均1年左右会产生耐药,研究发现这种耐受跟EGFR的T790M位点突变有关,阿斯利康又开发了针对T790M突变的第三代EGFR抑制剂泰瑞沙(奥希替尼),为耐药患者带来了新的生存希望。FLAURA研究数据成功将奥西替尼阵线前移至EGFR突变NSCLC一线治疗,“双沙”组合强强联手,阿斯利康牢牢占据NSCLC 靶向治疗战略高地。
DNA损伤应答
人体细胞内的DNA每天都会因为自然原因或外在因素发生成千上万次损伤,为了监测和修复DNA损伤,细胞已经进化出DNA损伤应答。很多癌症存在DNA损伤应答缺陷,这就使得细胞对DNA损伤更加敏感并更加依赖其他通路。如放疗和DNA损伤化疗等传统癌症治疗都是基于这一前提。但是这些治疗手段无法识别人体正常细胞和肿瘤细胞,通常会产生严重副作用和伤害。因此需要开发针对癌症特异性DDR依赖的治疗手段,这样既可以优先杀死癌细胞,又能将对正常细胞的影响降低到最小。
阿斯利康是基于DNA损伤应答机制进行新药开发的先行者,2014年12月上市了first in class的多聚腺苷二磷酸核糖聚合酶(PARP)抑制剂Lynparza(奥拉帕利)。PARP抑制剂参与DNA断链修复,由于健康细胞存在多条修复断链DNA的信号通路,PAPR抑制剂对健康细胞的毒性不会太大,癌症细胞有时会发生突变破坏其他DNA修复通路(DNA修复缺陷型肿瘤细胞),从而对PARP抑制剂尤其敏感。由于这种独特的机制,Lynparza的适应症已经扩大到铂敏感复发卵巢癌、BRCA突变Her2阴性乳腺癌,并且在胃癌、前列腺癌、胰腺癌的研究也推进到了III期阶段。
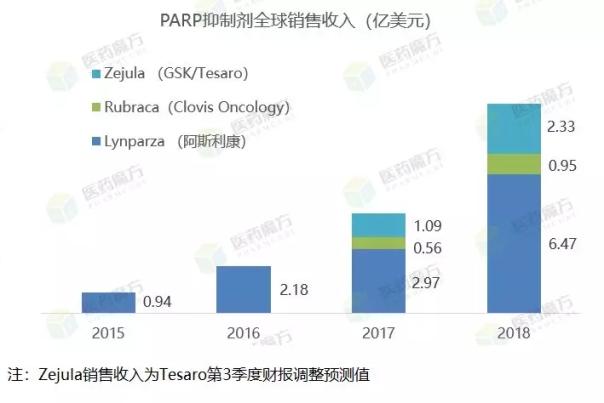
2017年7月,默沙东与阿斯利康达成一项总额85亿美元的交易,愿意和阿斯利康共同开发奥拉帕利,包括Lynparza单药或者联合 Imfinzi、Keytruda用于多种肿瘤适应症。
肿瘤免疫治疗
肿瘤的发生和进展与免疫系统有关是人类对癌症理解的第三大里程碑突破。正常情况下,免疫系统可以识别并清除新出现的肿瘤细胞。但为了生存和生长,肿瘤细胞能够采用不同策略,使人体的免疫系统受到抑制,不能正常杀伤肿瘤细胞,从而在抗肿瘤免疫应答的各阶段得以幸存。肿瘤免疫治疗为人体提供揭露肿瘤细胞的工具,增强免疫系统攻击有害细胞的能力,恢复机体正常的抗肿瘤免疫反应,从而控制与清除肿瘤。
PD-L1在肿瘤细胞中表达上调,与T细胞上的PD-1结合,抑制T细胞增殖和活化,使T细胞处于失活状态,诱导免疫逃逸。IMFINZI阻断PD-1和PD-L1的结合,上调T细胞的生长和增殖,增强T细胞对肿瘤细胞的识别,激活其攻击和杀伤功能,通过调动人体自身的免疫功能实现抗肿瘤作用。
IMFINZI获得FDA快速审批资格,在2017年5月获批,是全球第4个上市的 PD-1/PD-L1药物,治疗局部晚期或转移性膀胱癌的患者。Pacific研究数据显示,与安慰剂组相比,IMFINZI可显著延长III期不可切除NSCLC患者PFS至17.2个月(安慰剂组5.6个月),并于2018年2月被FDA批准用于治疗放化疗后疾病未进展的III期不可切非小细胞肺癌,填补了III 期非小细胞肺癌治疗空白。随着第二个临床研究终点OS阳性结果公布,IMFINZI 2018年全球收入直线狂飙,并且有多个单药或联合用药的III期临床研究正在进行中,应用前景可观。
抗体偶联药物
由于抗体药物对肿瘤细胞的杀伤力存在一定局限性,在临床使用过程中通常会与其他化疗药物联合应用。将抗体药物与细胞毒药物结合在一起,就可以综合两者的优势,具有靶向性强、细胞毒性高、毒副作用低和半衰期长等特点,更适合抗肿瘤治疗。
当前全球上市的抗体偶联药物屈指可数,也就意味着机会多多。阿斯利康正将该技术作为公司肿瘤业务的第4大机制研发管线进行布局,在2017年出手2亿美元投资了ADC Therapeutics。该公司的3个主要项目包括治疗CD25的淋巴瘤和白血病的ADCT-301、治疗非霍奇金淋巴瘤和淋巴细胞性白血病的ADCT-402,以及针对HER2靶点的治疗乳腺癌等实体瘤的ADCT-502,这些项目都处于早期临床阶段。在阿斯利康自己的研发管线中,MEDI4276是一种靶向HER2抗体偶联药物,但是同样处于早期临床阶段。这些早期阶段的项目自然无法满足阿斯利康在ADC领域的迫切需求,追求后期项目是当务之急。
通过上述介绍可以发现,阿斯利康围绕驱动基因和耐药、DNA损伤应答、免疫治疗这三大关键科学平台的布局已经非常成熟,而且颇有建树,无论是上市产品,还是在研管线,又或者是市场份额和地位,都已成为领军企业。毫无疑问,此次通过与第一三共合作引进一个处于III期的ADC项目,是阿斯利康对其抗体偶联药物平台进行的一次业务拼板,符合阿斯利康整体肿瘤业务的战略需要。
那么,13.5亿美元的首付,69亿美元的交易总额,贵不贵?值不值?
DS-8201:一个完美的目标
DS-8201(trastuzumab deruxtecan)是第一三共利用专有ADC技术开发的抗体偶联药物,其中抗体采用曲妥珠单抗,毒素是一个全新的拓扑异构酶I抑制剂喜树碱类似物,而连接子是一种四肽。药物抗体比约为8,这是传统半胱氨酸偶联技术所能达到的理论最大载药量。
DS-8201正被开发用于Her2阳性的癌症(包括乳腺癌和胃癌)以及Her2低表达的患者群体。在2017年,美国FDA已授予DS-8201突破性药物资格,用于已接受曲妥珠单抗(Her2单抗)和帕妥珠单抗(Her2单抗)治疗并且在接受Kadcyla(trastuzumab emtansine,TDM1)治疗后病情进展的Her2阳性、局部晚期或转移性乳腺癌患者。此外,日本厚生劳动省(MHLW)也授予了DS-8201治疗Her2阳性晚期胃癌或胃食管交界癌的Sakigake资格认定。
截止2018年4月18日的一项I期临床中期数据显示,99位曾接受曲妥珠单抗和Kadcyla(TDM1,大部分患者也还接受了帕妥珠单抗)治疗的Her2阳性转移性乳腺癌患者客观反应率54.5%,疾病控制率93.9%;而34位曾接受深度治疗的Her2低表达转移性乳腺癌患者客观反应率50.0%,疾病控制率85.3%。
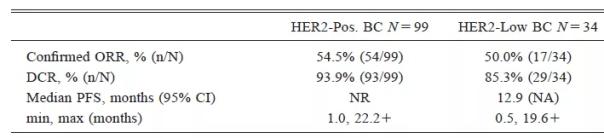
来源:Chem. Pharm. Bull. 67, 173–185 (2019)
正所谓道高一尺魔高一丈,几乎所有Her2阳性患者使用曲妥珠单抗系列药物之后都会产生耐药,所以对于Her2高表达的耐药患者来说一直都有巨大医疗需求。阿斯利康也看到了这一点。其实几乎在相同时候,阿斯利康也曾在接受过曲妥珠单抗和Kadcyla (TDM1,大部分患者也还接受了帕妥珠单抗)治疗的Her2阳性转移性乳腺癌患者中进行过IMFINZI联合曲妥珠单抗的初步临床试验,但未见明显临床获益。
因此可以毫不夸张地说,DS-8201就是阿斯利康梦寐以求的项目:1)DS-8201最大的优势是对既往抗Her2疗法失败的患者疗效显著,与重点适应症保持一致,可以完善其乳腺癌新药产品线。2)更重要的是,DS-8201在I期研究中对HER2低表达的乳腺癌患者(占乳腺癌患者的75%-80%)同样显示出优异的疗效,有望重新定义此类乳腺癌患者的标准治疗。3)DS-8201有多个关键的乳腺癌和胃癌II期和III期临床试验正在进行,有望尽快填补阿斯利康在ADC领域的上市产品空缺。
在引进DS-8201之后,阿斯利康在乳腺癌领域针对Her2阳性乳腺癌的治疗短板可以快速补强,如果再加上内分泌疗法、奥拉帕利、曲妥珠单抗类似物,阿斯利康有希望成为乳腺癌领域产品线最全的外资制药公司。这笔交易可以说也为阿斯利康壮大乳腺癌业务版图,加强乳腺癌领域的深度合作打下坚实基础。
加速推进,有条不紊
第一三共在宣布双方就DS-8201达成合作开发和商业化协议之际,也公布了上市计划,将向FDA提交上市申请的时间从原来的2020年提前到2019上半财年(日本企业财年是每年4月到次年3月)。而阿斯利康则表示会在2019下半年向FDA提交上市申请,综合双方信息可以推断应是在2019年第三季度。鉴于突破性疗法资格,PDUFA日期会在2020年第一季度。如果能够顺利获得美国FDA批准,将对DS-8201在其他地区药品监管机构审批产生积极影响。
当然,最快在2019Q3向美国FDA提交上市申请的前提条件是取决于一项关键II期DESTINY-Breast01研究的最终结果。考虑到中期数据十分喜人,预计将会也会看到一个不错的数据。有理由期待AZ拿着这份临床试验数据与FDA进行pre-BLA会议,预计将会也能够被FDA认可足以提交上市申请。
阿斯利康此次获得DS-8201的全球开发权益对于中国患者也是意义重大。中国女性乳腺癌发病率在184个国家中居第160位,死亡率居第177位。虽然发病率处于全球较低水平,但由于我国人口基数庞大,女性乳腺癌发病例数和死亡例数分别占全球发病和死亡的11.2%和9.2%,在世界范围位居前列。女性乳腺癌分别位居我国女性恶性肿瘤发病率和死亡率的第1位和第5位。2018年发布的数据是约27.89万例,占女性恶性肿瘤发病的16.51%;而2019年发布的数据是新增病例约为30.4万,占女性恶性肿瘤发病的17.10%,呈现上升的趋势。可以说中国女性乳腺癌患者对于新的更好的治疗手段始终都有强烈的需求。
中国已经成为阿斯利康全球业务中增长速度最快、收入占比日益增高的地区。阿斯利康对于在中国快速上市新药也是颇有心得。比如前文提到的第3代EGFR抑制剂奥希替尼,在中国从正式提交上市申请到获批用时不到7个月。此外,中国上市的首个全球first in class新药罗沙司他也是阿斯利康的代表作。在如此重视中国市场需求的情况下,如果说阿斯利康将中国作为DS-8201的优先考虑上市地区也不会让人意外。
从商业运营和患者诊疗角度考虑,阿斯利康中国围绕“三得”和奥拉帕利已经建立起了高效专业的乳腺癌、卵巢癌产品运营团队,对于医患双方的需求都十分了解。如果ADC药物将来可以在中国顺利上市,阿斯利康凭借丰富的产品组合和诊疗一体化的优势,可以给患者带来最大治疗获益,也将进一步奠定阿斯利康在妇科肿瘤治疗领域的王者地位。
