美国食品和药物管理局(FDA)仿制药办公室(OGD)本周发布2018年仿制药审批年度报告,突显了2018年是仿制药审批和新指导文件的又一个标志年。
在报告中,FDA OGD列出了2018年以及《仿制药用户付费修正案II》(GDUFA II)实施第一年期间取得的许多成就,包括:
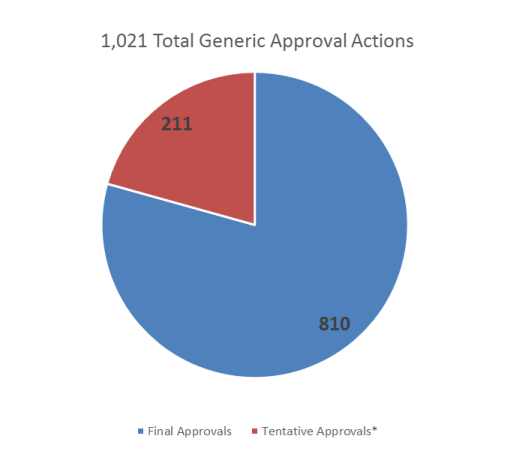
1.批准或暂时性批准了1021份新药简化申请(ANDAs),复杂仿制药占14%;首仿药占10%,其中复杂仿制药占18%。
2.发布250多篇新的或修订的指南、产品专用指南(PSG)、政策和程序手册(MAPP)。
3.成功实施了GDUFA II和2017年《FDA再授权法案》(FDARA)中的许多新规定,其中包括对ANDA提交前(pre-ANDA)会议请求、复议请求、对橙皮书的销售状态一次性更新,以及竞争性仿制药(CGT)认定、排他性请求,等等。
4.通过开展和分享监管科学研究、发布指导意见,并及时对受控函做出反应,持续促进建立强有力的仿制药管线。
5.保持可重复地高容量和高质量的审批产出。
6.创建了动态沟通流程,为行业提供了更高的透明度和可预测性。
7.推出一个新的在线功能接收企业受控函查询,并通过药物评估和研究中心(CDER)的门户网站(Direct NextGen Collaboration Portal)回应了大约700个此类查询。
8.发布了2648份完整回应函(CRL),详细说明了申请人在FDA批准之前需要解决的重要问题。
仿制药审批方面,FDA认为批准品牌药的首仿药是公共卫生优先事项,并加速审查这类申请。在2018年,FDA批准的重要首仿药包括:

指南发布方面,在2018年,OGD发布了6份指南草案、4份最终指南和2份政策和程序手册(MAPPS)。作为其努力使仿制药审查过程更加透明的一部分,OGD公布了一份行业指南草案《良好ANDA提交规范》(Good ANDA Submission Practices),详述了可能导致批准延迟的ANDA中的常见缺陷。
另外,OGD还发布了一份名为《良好ANDA评估实践规范》MAPP,概述了OGD和药品质量办公室的ANDA评估惯例,并正式确定了对ANDA评估效率的几项提高,以加速批准符合要求的仿制药。
关于FDA 2018年仿制药审批报告的其他详细内容,请查阅:2018 Office of Generic Drugs (OGD) Annual Report(新浪医药编译/newborn)
文章参考来源:
1、2018 in Generic Drugs: Approvals Shine but Questions Remain on Competition
2、2018 Office of Generic Drugs (OGD) Annual Report
