2月25日,国家药监局发布通知,批准复宏汉霖研发的利妥昔单抗注射液(HLX-01)上市申请,该产品成为我国首个获批的生物类似药。复宏汉霖联合创始人、总裁兼首席执行官刘世高曾经对媒体表示,在一品双规条件下,首个上市的产品有可能占据一半的市场。
利妥昔单抗是全球首个治疗非霍奇金淋巴瘤的单抗,据米内网数据,2017年该产品全球销售额为73.88亿瑞士法郎,在全球药品销售额排行榜中排位第五,在生物类似药的冲击下,其在2018年的全球销售额大幅下降;反观国内市场,罗氏的美罗华自获批进口后销售额逐年看涨,2017年顺利进入医保后放量可期。由于生物类似药研发壁垒高,罗氏多年来独占市场,随着复星医药产品获批上市,其余15家企业的产品步入赛道,利妥昔单抗国内市场格局或将改变。
利妥昔单抗,全球首个治疗非霍奇金淋巴瘤的单抗
利妥昔单抗是一种重组人鼠嵌合抗CD20单克隆抗体靶向药物,是全球首个被批准用于临床治疗非霍奇金淋巴瘤(NHL)的单克隆抗体。1997年11月26日,由罗氏及百健联合研发的利妥昔单抗注射液(英文名Rituximab,商品名Rituxan)获得FDA批准上市,1998年6月2日,该产品获得欧洲药品管理局(EMA)批准上市,商品名为MabThera;2000年3月15日,该产品获得国家药监局批准上市,商品名为美罗华。
相比于传统的非霍奇金淋巴瘤治疗方法,利妥昔单抗能特异性地针对B细胞,提高患者总生存率,还能避免损伤身体中的健康组织,毒副作用较小,因此成为治疗非霍奇金淋巴瘤不可或缺的药物。临床结果显示,利妥昔单抗联合CHOP化疗(环磷酰胺+阿霉素+长春新碱+泼尼松)可显著提升客观缓解率(ORR)至83%、完全缓解率(CR)至76%,7年总生存率至53%(化疗为36%),中高危病人提高至42%(化疗为28%)。
图1:2013-2017年罗氏利妥昔单抗注射液全球销售情况(单位:百万瑞士法郎)
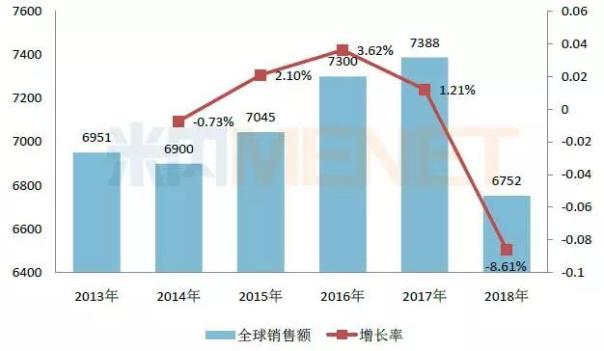
(来源:米内网跨国公司业绩库)
作为罗氏单抗三大巨头之一,利妥昔单抗连续多年跻身全球畅销药品排行榜TOP10,虽然该产品在欧洲专利保护期已于2014年底到期,面临着生物类似药的冲击,但2015-2017年其全球销售额仍呈现稳步上升的态势,2017年实现全球销售额73.88亿瑞士法郎,同比去年增长1.21%,在2017年全球畅销药品排行榜中排位第五。
2019年2月1日,罗氏公布2018年财报,集团全年实现收入568.46亿瑞士法郎,同比去年增长7%,其中制药业务收入439.67亿瑞士法郎,占集团总收入77.34%。随着利妥昔单抗在各国的专利陆续到期,越来越多的生物类似药获批上市造成冲击,2018年罗氏的利妥昔单抗全球销售额仅为67.52亿瑞士法郎,同比去年下滑8.61%,其中在欧洲市场收入同比去年下滑47%。
图2:2013-2017年中国公立医疗机构终端利妥昔单抗注射液销售情况(单位:万元)
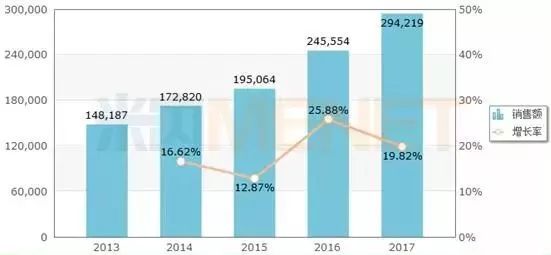
(来源:米内网中国公立医疗机构终端竞争格局)
罗氏的利妥昔单抗于2000年获得国家药监局批准进入中国市场,商品名为美罗华。近几年来,美罗华在中国公立医疗机构终端的销售额一直保持两位数的增长率稳步增长,2017年实现销售额29.42亿元,同比去年增长19.82%。
表1:2016-2018年罗氏利妥昔单抗注射液中标情况(单位:元/瓶)
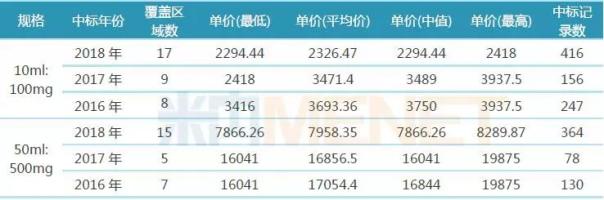
(来源:米内网中国药品招投标数据库)
2017年7月,罗氏的利妥昔单抗通过医保谈判进入2017年版国家医保目录,10ml:100mg、50ml:500mg规格的美罗华医保支付标准分别为2418元/瓶、8289.87元/瓶,据米内网中国药品招投标数据库,2017年10ml:100mg、50ml:500mg规格的美罗华平均中标价分别为3471.4元/瓶,16856.5元/瓶;2018年,各省开展抗癌药专项集中采购,美罗华价格进一步降低,据米内网中国药品招投标数据库,2018年10ml:100mg、50ml:500mg规格的美罗华平均中标价分别为2326.47元/瓶,7958.35元/瓶。
美罗华顺利降价进入医保,有望实现迅速放量,利妥昔单抗注射液在国内的市场将进一步扩大。由于生物类似药在工艺制备、上市审批和临床使用上具有较高的技术壁垒,近十年间利妥昔单抗国内市场由罗氏独占,如今随着复星医药的生物类似药获批上市,2019年该产品在国内的市场格局或将重构。
复宏汉霖联合创始人、总裁兼首席执行官刘世高曾经对媒体表示:从医院准入、销售布局来看,第一个上市的产品有巨大优势,按照过去的案例来看,很有可能占据一半以上的市场,很多医院实行“一品双规”,即一个产品只有原研药、和第一个进入市场的生物类似药两种,所以第二个进入市场的生物类似药开拓市场的难度就会大幅上升。
复星斩获我国首个生物类似药,定价如何?
2月25日,国家药监局发布通知,批准复宏汉霖研发的利妥昔单抗注射液(HLX-01)上市申请。截至2019年1月,公司针对该产品(包括非霍奇金淋巴瘤适应症及类风湿关节炎适应症)已投入研发费用约4.54亿元。
2007年,新版《药品注册管理办法》完成修订正式颁布,包括生物类似药在内的所有生物制品均按照新药上市流程进行申报;2015年,《生物类似药研发与评价技术指导原则(试行)》及《药品注册管理办法(修订稿)》相继出台,国内对生物类似药的监管逐步与国际接轨。按照国际标准,复星医药的利妥昔单抗注射液是我国首个获批上市的生物类似药。
据米内网MED药品审评数据库2.0,复宏汉霖于2017年10月提交了利妥昔单抗注射液的上市申请,适应症为非霍奇金淋巴瘤;同年12月11日,该产品的上市申请获得CDE承办受理,受理号CXSS1700026;2018年1月29日,该产品以“重大专项”为由纳入优先审评。2019年1月,该产品审评完毕,同年2月审批完毕,目前已获批生产。
利妥昔单抗是复星医药开发的第一个生物药,据公司披露的III期临床数据,该产品与原研药(美罗华)在治疗CD20阳性弥漫型大B非霍奇金淋巴瘤(DLBCL)初治患者的临床试验主要终点、次要终点(安全性、免疫原性、药代动力学)均达到预设标准。
据悉,罗氏的利妥昔单抗在欧洲的专利保护已于2014年底到期,在美国的专利于2018年下半年到期。2018年3月,我国专利复审委作出第35201号无效宣告审查决定,宣告百健第200510062686.8号"包括施用抗-CD20抗体的B-细胞淋巴瘤联合疗法"发明专利(第686号专利)全部无效,这意味着复星医药的利妥昔单抗生物类似药上市销售已无专利障碍。
虽然美罗华通过谈判降价进入医保,但其费用对患者来说仍旧具有一定负担,复星的生物类似药上市后能否迅速覆盖有实际用药需求但是不能负担药价的患者,这有赖于其产品的定价,从市场角度来看,生物类似药降价幅度普遍为原研的10%~35%,复星会如何定价?我们拭目以待。
16家国内企业布局,美罗华类似物研发竞争激烈
据米内网全球药物研发库,目前全球已有多个利妥昔单抗生物类似药获批上市,包括印度intas制药、瑞迪博士实验室、诺华等企业的产品。此外,罗氏后续研发的第二代人源化抗CD20抗体奥比妥珠单抗(英文名Obinutuzumab,商品名Gazyva)和奥瑞利珠单抗(英文名ocrelizumab,商品名Ocrevus)也分别于2013年、2017年获得FDA批准上市。
反观国内市场,目前布局利妥昔单抗生物类似药开发的制药企业超过十家,包括信达生物、海正药业、正大天晴、丽珠单抗等知名企业,竞争非常激烈。
表2:利妥昔单抗生物类似药国内研发进展

(来源:米内网MED药品审评数据库2.0)
从研发进展看,中信国健的重组抗CD20人鼠嵌合单克隆抗体注射液最早提出上市申请,但由于临床数据规范性问题而撤回;复宏汉霖的利妥昔单抗注射液的上市申请于2017年12月获得CDE承办受理,目前已获批生产,此外,该产品针对类风湿性关节炎的适应症处于临床III期阶段。
研发进展比较靠前的还有信达生物、神州细胞工程、浙江海正药业、正大天晴药业、优科生物、喜康生物等企业,其相应的产品均已进入临床III期。
来源:米内网数据库、上市公司公告、中泰证券研究所等
