炎症性疾病和感染与包括贫血和血小板减少在内的血细胞减少(cytopenia)有关。这些疾病的共同点是通过识别病原体来源分子的受体来激活先天免疫系统,包括单核细胞/巨噬细胞谱系。Toll样受体(TLR)是一类病原体传感蛋白,可识别细菌和病毒配体,比如通过TLR7和TLR9识别病原体来源的核酸。TLR不仅识别病原体,导致感染清除,而且它们也与炎症和自身免疫疾病有关。单核细胞和/或巨噬细胞中的TLR信号转导如何参与与炎症和感染相关的血细胞减少尚不完全清楚。
图片来自Science, 2019, doi:10.1126/science.aao5213。
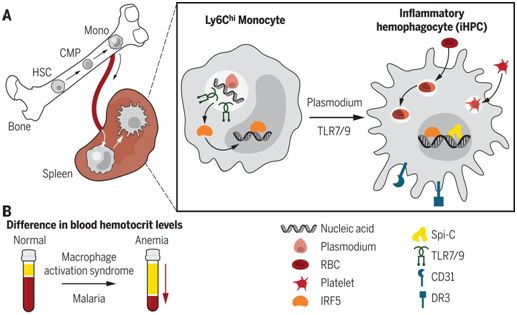
对红细胞、血小板和白细胞的吞噬可能是急性血细胞减少的主要原因。因此,在一项新的研究中,来自美国贝纳罗亚研究所和华盛顿大学的研究人员推断作为对模式识别受体(比如TLR)信号转导作出的反应,特定的吞噬细胞可能在炎性条件下产生。在体外,TLR信号转导可直接诱导巨噬细胞产生。然而,TLR诱导的巨噬细胞分化是否确定了一种不同于稳态巨噬细胞分化的特定巨噬细胞命运仍然是不清楚的。为了解决这个问题,这些研究人员进行了体外和体内研究,以便探究TLR诱导的巨噬细胞分化以及这个过程在炎症性血细胞减少中的作用。
通过在体外对经过TLR7信号转导诱导后发生分化的巨噬细胞进行转录分析,这些研究人员发现这些细胞具有与红髓巨噬细胞(red pulp macrophage, RPM)---脾脏中的稳态巨噬细胞---相类似的基因特征。通过使用TLR7驱动的炎症小鼠模型(即TLR7.1小鼠),这些研究人员发现一群噬血细胞(hemophagocyte)在细胞表面表型上与RPM不同,而且也不存在于未发炎的野生型小鼠中。因此,他们将这些细胞称为“炎性噬血细胞(inflammatory hemophagocyte, iHPC)”。iHPC与RPM都表达转录因子Spi-C,但是表现出对红细胞的更高的吞噬摄取。因此,尽管与RPM相类似,但是iHPC是一种独特的噬血细胞群体。
iHPC需要细胞内源性TLR7信号转导用于它们的产生,并通过IRF5由炎性Ly6Chi单核细胞分化而来。基于TLR7或TLR9但不基于TLR4、TLR3、IL-1β或干扰素-γ的信号转导诱导这些单核细胞出现iHPC表型,而且单核细胞的慢性耗竭导致iHPC的数量严重减少。随着年龄的增加,TLR7.1小鼠表现出渐进性严重贫血和血小板减少,但是通过单核细胞耗竭阻断iHPC分化挽救了这些炎性血细胞减少。这些研究人员接下来想要知道感染促进的贫血和血小板减少是否也涉及iHPC。利用红细胞内期的约氏疟原虫17XNL(Plasmodium yoelii 17XNL)感染小鼠(一种疟疾性贫血模型)显示MyD88和内体TLR依赖性的iHPC分化。因此,iHPC在无菌性血细胞减少和传染性血细胞减少的情形下都会发生分化。
总之,这些研究人员鉴定出一种之前未知的TLR7/9驱动的与炎症性血细胞减少相关的单核细胞分化途径。他们提出巨噬细胞激活综合征(macrophage activation syndrome, MAS)可能是由iHPC引起的,而且这些细胞也引起严重的疟疾性贫血,其中巨噬细胞激活综合征是风湿性疾病或与急性血细胞减少相关的病毒感染的一种危及生命的并发症。他们的研究提出一种治疗巨噬细胞激活综合征、重度疟疾性贫血和“炎症性贫血(anemia of inflammation)”的新途径。
参考资料:Holly M. Akilesh et al. Chronic TLR7 and TLR9 signaling drives anemia via differentiation of specialized hemophagocytes. Science, 2019, doi:10.1126/science.aao5213.
原标题:Science:重大进展!揭开炎症性贫血的神秘面纱
