原创: 苏扬
多种活化T细胞的肿瘤免疫疗法能够有效治疗多种类型的癌症。但由于血脑屏障的存在,使得免疫细胞无法有效浸润脑部肿瘤,这也是免疫治疗难以对胶质母细胞瘤起效的一个很重要的原因。
血脑屏障阻碍免疫细胞进入脑内其实是一种保护机制,能够有效的防止免疫细胞浸润脑部从而引发致命的脑内炎症。在一般情况下这种保护作用对人体的有益的,但对于胶质母细胞瘤患者来说,血脑屏障的存在使T细胞无法到达脑内肿瘤所在的位置,从而使胶质母细胞瘤成为我们通常所说的“冷肿瘤”。
在本周Nature上发表的一篇论文中,来自埃及儿童癌症医院以及美国德克萨斯州的科学家报道了一种新的方式来促进T细胞在小鼠脑内的浸润,这种方法有可能会提高胶质母细胞瘤对免疫疗法的响应。
脑炎患者之所以出现脑内炎症,是因为免疫细胞跨越了血脑屏障进入脑内从而引发了炎症。T细胞向脑内迁移是通过多步骤协调来完成的。
血液中的T细胞首先要黏附在血管的内皮细胞上,黏附的过程是由T细胞表面的配体与内皮细胞表面的ALCAM以及ICAM-1等细胞黏附分子结合而介导的。这些黏附分子会在脑炎形成时过表达,ALCAM与T细胞配体CD6结合能够阻止T细胞在血管内继续向前迁移,在这之后ICAM-1以及VCAM-1会与响应的T细胞表面配体结合。
当黏附分子的结合达到一定的阈值之后T细胞就会向内皮细胞之间的缝隙迁移从而从血管进入脑内。
但是在胶质母细胞瘤中,由于脑内的血管结构存在异常,使内皮细胞的ICAM-1 以及VCAM-17表达水平非常低。如果能够模拟脑炎患者的特定状态,强化胶质母细胞瘤患者T细胞与内皮细胞的黏附的话,就有可能使更多的T细胞向患者脑内迁移。
研究人员发现,胶质母细胞瘤患者的内皮细胞存在ALCAM过表达,因此他们认为通过改造T细胞,使其能够与ALCAM紧密结合的话就有可能促进T细胞向脑内迁移。
接下来研究人员设计了一个来源于CD6的ALCAM的合成配体HS-CD6,并使用逆转录病毒载体将相关基因导入到T细胞的基因组中。之后他们发现表达HS-CD6配体的T细胞能够与表达ALCAM的内皮细胞紧密结合。体外实验也发现该结合能够促进该T细胞向内皮细胞间迁移。
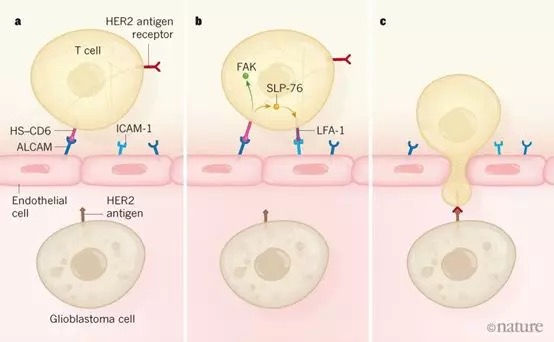
接下来研究人员在该类T细胞上引入能够识别HER2的嵌合抗原受体,验证这类细胞是否能够有效进入小鼠脑内并杀灭肿瘤细胞。他们发现该经过改造的T细胞能够成功浸润胶质母细胞瘤,并且完全清除大部分小鼠脑内的胶质母细胞瘤并维持长期缓解。而作为对照,那些只表达嵌合抗原受体的T细胞并不能成功进入小鼠脑内。
该项研究为使用免疫疗法治疗胶质母细胞瘤提供了一个比较有潜力的方向。但是在进入临床试验之前却仍然有非常多的困难需要克服。
首先,ALCAM能够在多种类型的细胞表面表达,包括骨髓细胞,因此后续的研究必须确定该类细胞是否能够影响这些细胞的正常功能。
此外,如果T细胞产生脱靶效应对正常组织产生伤害的话,就有可能以直接或者间接的方式引发严重的毒性反应。因此使用能够限制T细胞活化以及生存期的策略,比如在T细胞上安装安全开关将有可能能够控制这种毒性反应。虽然实验过程中小鼠的存活期比较长,也提示该实验中使用的方法可能并不会引起脱靶毒性反应,但是该实验并没有研究这些CAR-T细胞在脑内的存活时间,因此现在也无法确定这些细胞是否会产生脱靶效应。
最后需要注意的是,跨越血脑屏障虽然是系统应用CAR-T疗法治疗胶质母细胞瘤研究中很重要的一步,但即使在人体内完成这一步也不以为着就能够克服胶质母细胞瘤治疗的障碍。
CAR-T细胞在进入脑内之后会遭遇肿瘤微环境中的各种免疫抑制因素。而且这种免疫抑制状态是实验动物很难模拟的,因此该类细胞虽然在实验动物中能够有效清除胶质母细胞瘤,但对于临床试验的预测价值并不是非常高。可能之后的研究将会依赖于组合疗法,比如联用PD-1/L1抑制剂,使T细胞不仅能够进入脑内,还能够长期存活并且长期维持有效的抗肿瘤反应。
参考文献
1. 10.1038/s41586-018-0499-y
2. 10.1038/d41586-018-05883-7
