作者: 胡斌+音 sir
加快药审就是让针对一些市面上特别需要的「优等药」以最快的速度完成审评审批,然后上市。这种与「普通药」区别对待,也就催生了一系列加快药品审评审批制度。
我们通常管这些政策叫 CFDA 的绿色通道。
本文梳理中国药品加快审评审批的前世今生,对目前并行的 3 个绿色通道的批准速度进行了对比分析,以便大家更好的理解药品加快审批的制度。

中国在加快药品审评上做过哪些努力?
1. 特别审批
2005 年 11 月 18 日,发布《国家食品药品监督管理局药品特别审批程序》(局令第 21 号),最早的加快审批制度出炉,主要针对重大突发卫生事件用药,如比如 SARS 的灭活疫苗,H7N9 的帕拉米韦,ZIKA 的试剂盒。
点评:与其说是加快,这种制度更可以理解为紧急审批,它要求审评机构在资料接受 24 小时内启动审评,并且在 15 天内完成第 1 轮审评(即给出审评结论)。该法规似乎是在 SARS 过后制订的用于防患于未然的行政措施。
成果:猜测是因为涉及品种太少,没有对特别审批进行公开,具体数据不明。
2. 重大专项
2006 年 2 月,国家中长期科学和技术发展规划纲要(2006-2020)中指出国家重大科技专项,其中涉及医药行业的即为重大专项,全称是「重大新药创制科技重大专项」,目前主管部门为卫计委科技教育司新药专项实施管理办公室。
一般每年中旬按照定向择优课题提出申请次年申请,不定期的组织专家进行审评,进行公开(可在卫计委科技教育司网站上查询),一般 3 年为一个课题周期。
点评:大部分 1.1 类新药都申请了重大专项,尤其是耳熟能详的几家大企业和科研院校,比如知名的埃克替尼、西达本胺,但是重大专项不止是创新药物才能申报,对于一些新剂型,中药再评价也可以申报。
成果:根据丁香园 Insight 数据库,目前有 323 条受理号获得重大专项资格,共计 149 个品种。
3. 特殊审批
2009 年,药品注册特殊审批实施,该制度主要用于鼓励创新药物。按照这条途径,临床申请的技术审评时限从 90 天缩短至 80 天,报产申请的技术审评时限从 150 天缩短至 120 天。
特殊审批品种范围:

点评:在过往实践中,由于排队时间远长于审评时限,使得这种获益显得比较鸡肋。但该资格的最大获利在于有机会与 CDE 进行会议沟通,在申请递交之前了解 CDE 审评人员的观点,有助于后续的研发工作。
结果:根据丁香园 Insight 数据库,目前有 1976 条受理号获得特殊审批资格,共计 686 个品种。
4. 加快审评审批
2015 年 2 月 30 日 CFDA 颁布的《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告 (2015 年第 230 号)》中规定了 8 种情况可以进行「加快审评」,并可在 2015 年 12 月 1 日起,向 CDE 进行申请。
点评:可以看做是改革过程中「优先审评」的过渡期办法。
结果:根据丁香园 Insight 数据库,目前有 112 条受理号获得加快审批资格,共计 38 个品种。
5. 优先审评(2016 年 2 月)
优先审评出台的大背景是整个药品监管政策的改革和解决药品审评积压。
优先审评品种范围:

点评:迄今为止,加速药品审评的最有力的工具。它主要聚焦于临床价值,并且在纳入之前需经过专家组论证和网上公示。具有显著临床优势的创新药在优先审评中获益最大,具备长久技术和经验积累的国外药企可能在近期从该政策中获益较多。相信这是一条必经之路,将吸引国外企业将真正创新的药物更快引进中国。。
结果:该文件现已废止。根据丁香园 insight 数据库统计,以活性成分计共有 191 个品种纳入优先审评名单中。从企业分布来看,国产品种 100 个,进口品种 91 个,从纳入原因来看,创新药仍然占主要部分(n=76)。其次是儿科药(n=33)和首仿(n=29)。
这里需要提出的是,在优先审评实施的初期,存在较多的重大发补,2016 年 2 月优先审评发布后,但发补数量减少为 0,全部采取一次性通过,可见排队和初次审评时间直接决定了最终的批准时间。
6. 鼓励药品创新实行优先审评审批(2017 年 12 月 28 日)
主要目的是加快具有临床价值的新药和临床急需仿制药的研发上市。
点评:2016 年优先审评政策的完善和补充。
加快审评审批下的批准速度到底有多快?
5 个加快药审的通道,目前特殊审批、重大专项、优先审评仍然在并行之中。有些品种只获得特殊审批、优先审评和重大专项的其中一个资格,也有部分品种同时获得 2 个甚至 3 个资格。
以下对于特殊审评、重大专项、优先审评、特殊审评+重大专项、特殊审评+优先审批、重大专项+优先审批、特殊审评+重大专项+优先审批 7 种情况的审评速度进行了分析。

1.特殊审批的批准速度
2017 年 CDE 承办到获得批件用时:186 天(较 2016 快了 65 天,2018 将更快)
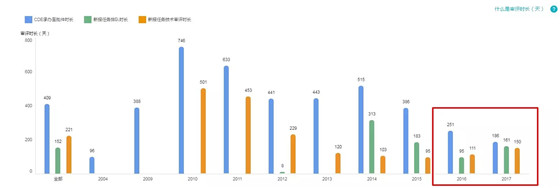
备注:
1. CDE 承办至批件时间(图中蓝色柱子)为药物被承办开始审评审批到发批件(临床/上市/进口)花费的时间,横坐标即为该药物 CDE 承办的年份
2. 一般情况下新报任务时长(图中绿色柱子)+新报任务技术审评时长(图中橙色柱子)的时间要小于 CDE 承办至批件时间(图中蓝色柱子),但各个柱子样本量不一样导致出现细微差别
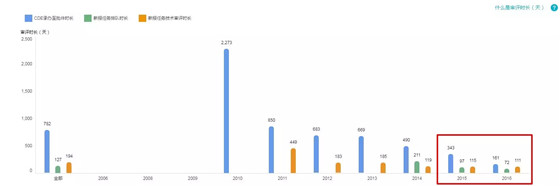
2.重大专项的批准速度
2017 年 CDE 承办到获得批件用时:161 天(较 2016 快了 182 天,2018 将更快)
3.优先审评的批准速度
2017 年 CDE 承办到获得批件用时:176 天(较 2016 快了 129 天),已经达到美国 FDA 优先审评(PriorityApproval)的水平!
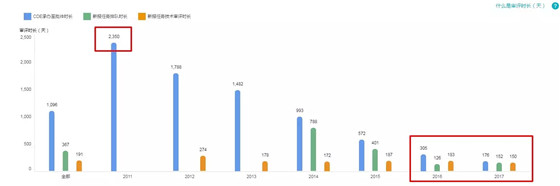
从丁香园 Insight 数据库来看,可以看到,2016 年 2 月 26 日正式实施的优先审评除了对新报任务适用,对过往申报也发挥了作用,如图中 2010 年 CDE 承办的药品。
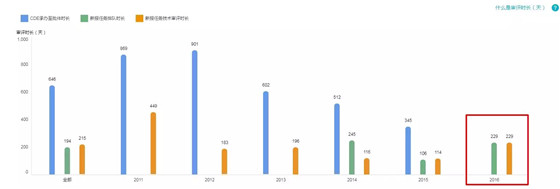
4.特殊审评+重大专项
受理号数量:164
无 2016 年和 2017 年 CDE 承办到获得批件的品种
5.特殊审评+优先审批
受理号数量:50
2017 年 CDE 承办到获得批件用时:140 天(「双通道」品种在 2016 年和 2017 年的批准时间均比单通道品种短)
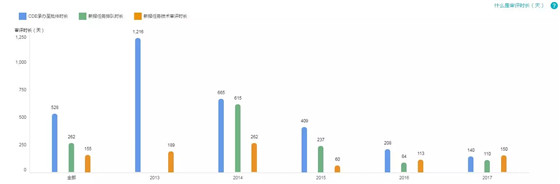
6.重大专项+优先审批
受理号数量:6
仅 2016 年出现了这两个通道的受理号
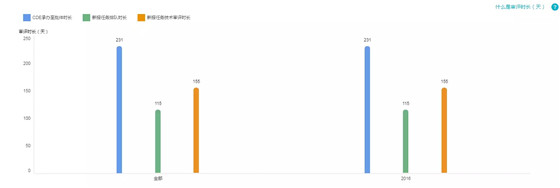
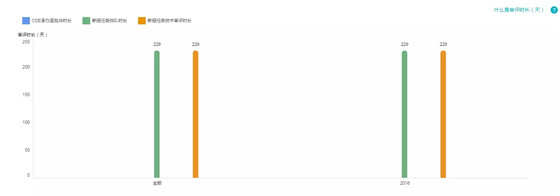
7.特殊审评+重大专项+优先审批
受理号数量:2
仅 2016 年出现了这三个通道的受理号
革命尚未成功,还得努力
对企业而言,进入「绿色通道」意味着缩短药品审评时间成本,并且降低发补甚至不批准的风险。
从 2005 年至今,从政策上看,CFDA 一直在努力推进,也不断在完善着。
但从平均值上看,加快药审的受理号从 CDE 承办到获得批件大多在 140-180 天,相比于「非绿色通道」的品种差距不大,也并没有因为进入多个绿色通道而更快完成审评,当然因为是平均值,不排除有个别品种拖后腿。
猜测也与申报的品种越来越多,需要沟通指导更多,而审评人手有限有关。如果希望达到「绿色通道」的品种速度远超「非绿色通道」,还有很多细节的工作需要做。
