作者: 高嵩
创新药研发迎来热潮,比起临床试验病人不足,研究者不足及创新临床试验方法使用不足是更加亟待解决的问题。
以2015年“722风暴”为起点,药监推动一系列新政落地,新药临床开发、审批的过程得到明显加速,国家鼓励医药产业向创新药方向转型的政策意图明显。从药企、临床CRO到资本等医药产业链条上的各个环节都在向创新药方向作调整。
创新药落地,临床试验至关重要。临床试验成本占到新药开发整体成本的60%,临床试验能否顺利推进直接决定了创新药最终的成败。资本、本土药企逐渐将重心向创新药领域转移,但随之而来也在临床试验环节遭遇到竞争集中的问题:创新药申报临床适应症集中,癌症靶向药靶点单一等。甚至于行业中有声音质疑说:所有药企都去搞创新药,创新领域又比较集中,那么临床病人是不是不够用?
近日,精鼎医药(PAREXEL International Corporation)联合经济学人智库发布了《创新势在必行:药物研发的未来》研究报告,该报告研究了适应性试验、以患者为中心临床试验等多种创新方法在中国、美国、欧盟及日本新药临床试验中的落地情况。
精鼎医药作为全球营收规模排名第四的CRO跨国企业,早在2002年便在中国成立公司开展业务,而精鼎亚洲地区员工人数更是超过美国及欧洲地区,中国则是精鼎最重要的市场之一。其作为最早进入到中国的跨国CRO企业,对中国新药临床试验状况有着长期且深入的观察,叠加其在其他区域的业务经验,能够很好的定位中国新药临床试验的位置并找出存在的问题。
创新药大潮下,临床病人是不是不够用了?创新药临床试验在患者招募、药品上市等环节想要提升效率,有哪些改进的方法?这些方法在中国落地存在哪些瓶颈需要突破?E药经理人记者采访精鼎医药高管团队,得到了针对上述问题的答案。
1、本土药企向创新药转向
“在过去的三年多时间中,中国临床试验的环境发生了很大的变化,2015年7月份的‘722风暴’以后,临床开发、审批的过程得到了加速。中国政府正在大力提倡药物创新,开发创新药的生物制药公司的数量正在快速增加。” 精鼎医药临床研究运营副总裁李刚说。
实际上,临床试验审批的数字也很好印证这种转向。CFDA发布2017年度药品审评报告显示,药审中心批准创新药临床试验申请批准创新药临床试验申请399件(共涉及170个品种),较2016年创新药临床试验批准数量翻了一番。
作为服务药企的CRO企业,精鼎也在临床试验的细节中感受到了本土药企研发创新药的热情。李刚讲到说,精鼎医药目前50%业务都来自于中国本土药企,以往本土药企在寻求CRO服务时更关注价格,但现在更多会考虑CRO的品质和质量,很多本土药企在做创新药时会想做一些跨国的多中心临床试验,这部分药企的数量占到了30%。
资本在政策的助推之下,投资方向也在由仿制药企向创新药企转换。德同资本合伙人杨昆在接受采访时表示,带量采购等政策的落地实施对于仿制药的冲击比较大,而中药的疗效面临冲击,辅助用药的机会也越来越小,相关项目分析的难度和强度在变大,而伴随国家政策的支持,医保将创新药纳入,国外的研发人才回流趋势日趋明显,中国在创新药领域逐渐在向国际领先水平,因此资本在创新药领域中察觉到更多的投资机会,也更加愿意投资创新药企。
资本助力创新药,但难免有扎堆儿适应症和靶点的情况。德同资本合伙人杨昆在接受采访时也表示,目前创新药市场存在泡沫,很多做靶向药的药企都集中在几个靶点上进行布局,最终市场回归理性后,没有真正技术实力的企业会被淘汰掉,让真正的金子发光。
2、病人不缺,缺有经验的研究者
药企扎堆在创新药研发领域,布局的靶点和适应症又比较集中,临床试验的病人会不会不够用?
“在中国的情况不能一概而论说患者不足,需要根据不同疾病领域进行具体分析。其实绝大多数的情况下,并不是患者不足,而是研究者不足,临床试验都是通过研究者招募到患者。这个情况现在变得越来越剧烈,创新药趋热,研究数量增加,研究者的短缺越发明显。” 精鼎医药临床研究运营副总裁接受采访时说到。
中国的临床试验研究者有多缺?精鼎医药临床研究运营副总裁Jamie Macdonald在接受采访时表示,在北美市场,有大概3%的医务人员会参与到临床试验,能够按照ICH的标准去做临床试验,而在中国能按照ICH标准做临床试验的机构不足1000家,研究者的不足是在中国做临床试验遇到的最大的挑战。
实际上,国家层面已经在政策层面为临床试验机构“松绑”。2017年10月,药监局发布政策将药物研发临床试验机构资格认定改为备案制,在从政策层面促进临床试验机构的落地。精鼎方面也借此政策机遇与30多家机构建立合作关系孵化临床试验机构,以解决临床试验研究者不足的问题。
研究者不足只是临床试验环节面临一个问题,临床试验要助力中国本土创新药落地,需要使用更加创新的方法加速临床试验进展。
3、创新药,更需要临床试验的创新
临床试验中,创新方法使用情况如何?这些创新方法对于药品上市有何帮助?精鼎医药联合经济学人智库发布的报告对于北美、欧洲、中国及日本4地2012年至2017年期间约4000项使用创新方法的 II期和 III期试验,与同一时期未使用所选创新方法的约20000项试验的对照组进行了对比。
报告显示,适应性试验、以患者为中心的试验、精准医学试验和真实世界数据试验四个创新领域对药物的临床试验进程、上市概率以及纳入处方集具有积极影响——使用这些创新可以将药物的上市概率提高10%-21%;在重要治疗领域(神经学、肿瘤学和罕见疾病)中,使用这些创新进行开发的药物更有可能达到上市标准,上市概率平均可提高16%,其中肿瘤学领域的药物开发受这些创新的影响最大,该领域中的药物上市概率提高了33%。
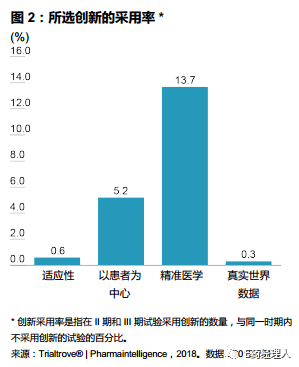
尽管数据评估证明创新对药品开发有很大的积极作用,但由于一些制度和文化上的障碍,这些创新的实际采用率很低:适应性试验和真实世界数据试验的采用率不到1%,以患者为中心的试验的采用率为5.2%,精准医学试验的采用率为13.7%。在试验总数方面,欧盟和美国在每个创新领域中都占有最大的比例,分别为 33-34% 和 36-46%,而中国仅占1-6%,远远低于欧美发达市场。
根据中国外商投资企业协会药品研制和开发行业委员会(RDPAC)与其他六家行业及学术协会于2017年共同发布的一项研究报告,中国临床研究的发展已经落后于医药创新产业链其它环节,而且对临床研究的需求与临床研究资源之间的不平衡正在加剧。临床研究的能力和资源问题若得不到及时解决,将至少延缓中国创新药产业发展进程五到十年。
当前创新药研发迎来热潮,而临床试验是创新药能否上市的决定性环节,病人不够用只是表面现象,只有培育了足够多临床研究者,并且以患者为中心的临床试验等创新方法在临床试验环节得到充分使用,才能为本土创新药问世搭建良好的基础设施。
原标题:创新药大潮下,临床病人不够用了?
