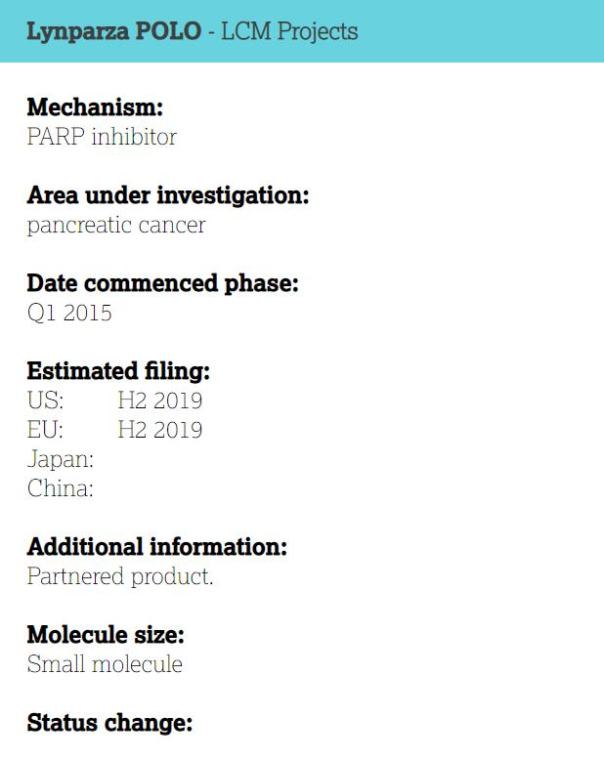
10月16日,阿斯利康及美国默沙东制药表示,LYNPARZA(olaparib,奥拉帕尼)用于胰腺癌治疗获得了美国FDA授予的孤儿药认定。该药物目前正在进行用于胚系BRCA突变转移性胰腺癌患者(其疾病在一线铂类化疗后仍未进展)的治疗研究。
胰腺癌是一种罕见的、危及生命的疾病,约占美国所有癌症的3%。由于症状的晚发,患者通常在癌症进展到疾病的局部晚期或转移阶段后才被诊断。在美国,胰腺癌患者的5年生存率仍然很低,一般为8.5%。
Lynparza是一种全球首创(first-in-class)PARP抑制剂,也是第一个有潜力利用DNA损伤应答(DDR)通路缺陷(如BRCA突变)来优先杀死癌细胞的靶向治疗方法。该药物由阿斯利康和默沙东联合开发和商业化,除了已上市适应症外,正在进行多个临床试验项目的开发以期用于更多类型肿瘤患者的治疗。
阿斯利康公司负责全球药物开发的执行副总裁Sean Bohen说:“胰腺癌是一个重要的医疗需求未得到满足的领域,对于转移性疾病的患者来说尤其如此,因为目前的治疗方案的获益非常有限。”
默沙东研发实验室副总裁兼全球临床开发主管Roy Baynes博士表示:“胰腺癌是一种相对不常见但危及生命的癌症,美国FDA的孤儿药物认证加强了我们合作将LYNPARZA带到有需要的病人身上的重要性。”
这是LYNPARZA在美国获得的第四项孤儿药认定。2013年10月,该药物获得了治疗卵巢癌的孤儿药认定。2018年早些时候,继美国FDA于2017年8月扩大批准Lynparza用于复发性上皮性卵巢、输卵管或原发性腹膜癌患者进行维持治疗后,又对Lynparza用于输卵管和原发性腹膜癌治疗给予了孤儿药认定。

LYNPARZA目前获批情况(来自新浪医药)
目前,该药物用于胰腺癌治疗的临床3期POLO研究正在进行中,试验将与安慰剂对照,研究LYNPARZA(300 mg,一天两次)作为维持性单药疗法治疗gBRCAm转移性胰腺癌患者的疗效和安全性,其中这些患者在一线铂类化疗后疾病没有进展。该试验入组145名患者,会按照3:2随机接受LYNPARZA或安慰剂给药,主要终点是无进展生存期。预计POLO试验的结果将在2019年上半年得到。(新浪医药编译/David)
文章参考来源:
1、U.S. FDA Grants LYNPARZA® (olaparib) Orphan Drug Designation for Pancreatic Cancer
2、https://www.astrazeneca.com/our-focus-areas/oncology.html
3、PARP抑制剂肿瘤研发最新进展 亚洲市场潜力巨大
