今天阿斯利康和合作伙伴Array生物医药宣布其MEK抑制剂selumetinib在一个KRAS变异肺癌三期临床失败。这个叫做SELECT-1的试验招募510位KRAS变异、一线用药复发肺癌患者,比较selumetinib与多西他赛联用和单独使用多西他赛作为二线药物对PFS和OS的影响。结果selumetinib未能改善PFS或OS。这是继去年在黑色素瘤三期失败后selumetinib再次遭遇重挫。AZ今天股票下滑1%,而其合作伙伴Array则暴跌23%。
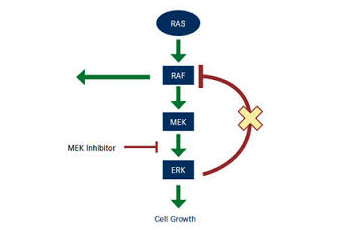
Selumetinib是MEK抑制剂,在RAF和RAS下游抑制MAP/ERK通路。这条调控路线是细胞分化、增长的重要调控机制,恶黑有50% BRAF变异,而肺癌有~25% KRAS变异。MEK抑制剂和BRAF抑制剂联用已经有两个组合上市用于恶黑(罗氏Cotellic/Zelboraf、葛兰素(已卖到诺华)Taf/Mek),但尚未在肺癌上市。三年前在一个同样人群的二期临床中,同样剂量的selumetinib显着增加应答率和PFS,虽然OS改进未能达到统计显着。但selumetinib在今天这个大型三期彻底错过所有试验终点。
MAP/ERK通路是肿瘤增长的重要调节机制,变异RAS、RAF也被公认是致癌基因,但是抑制MEK却相当复杂。一是这条通路有不少结构类似但功能相反的激酶,而任何激酶抑制剂不可能100%高选择性。一个MEK抑制剂的所谓脱靶活性决定了最后这个化合物的综合疗效。另外开发这些靶向药物的时候对免疫系统的影响并未作为一个主要考虑,而MAP/ERK也是T细胞活化信号的主要调控机制。早期的研究显示MEK抑制剂如selumetinib、trametinib能减弱T细胞活化信号,但是BRAF抑制剂却出人意料地增强T细胞信号。这或许是二者组合显示疗效的原因之一。
但今年发表在《Immunity》上的一篇文章发现使用另一个MEK抑制剂G-38963却能降低T细胞疲劳造成的T细胞损失,所以有助于免疫系统对肿瘤细胞的清除。肿瘤患者的免疫系统在诊断时可能已经和肿瘤交战多时,这些二线患者的免疫系统更是备受挑战。如果所有MEK都能缓解T细胞疲劳按理说应该有助于肿瘤的清除,但这只是临床前动物模型结果,而这个化合物是否真的是极高选择性MEK抑制剂也不好说。
Array以外包服务开始,但后来因为外包向中国转移也开始做自己的创新药物。AZ最近除了T790m EGFR抑制剂Tagrisso外鲜有重要产品出现。其PD-L1抗体durvalumab和从辉瑞收购的CTLA4抗体tremelimumab开发也是磕磕绊绊,进展不如其它主要竞争对手。过去10年AZ靠两个me too重磅药物Nexium和Crestor支撑,而这类药物已经在现在的支付体系内没有生存空间。AZ现在需要忘掉这两个药物的“成功经验”,找回开发质子泵抑制剂时的胆略和智慧。否则躲过辉瑞也躲不过诺华,难免成为下一个大型收购的牺牲品。
